您的
智能关务管家

400-099-9825




您的
智能关务管家

400-099-9825







科橘OTECH

2020-03-31
随着欧美疫情的日益严重,针对欧美出口的需求也越来越大。那么CE和FDA认证具体如何进行,有哪些流程呢?小科最近联系了一家国内知名的正规代理机构,以下就是他们给到的以口罩为例的,标准CE和FDA的认证过程。
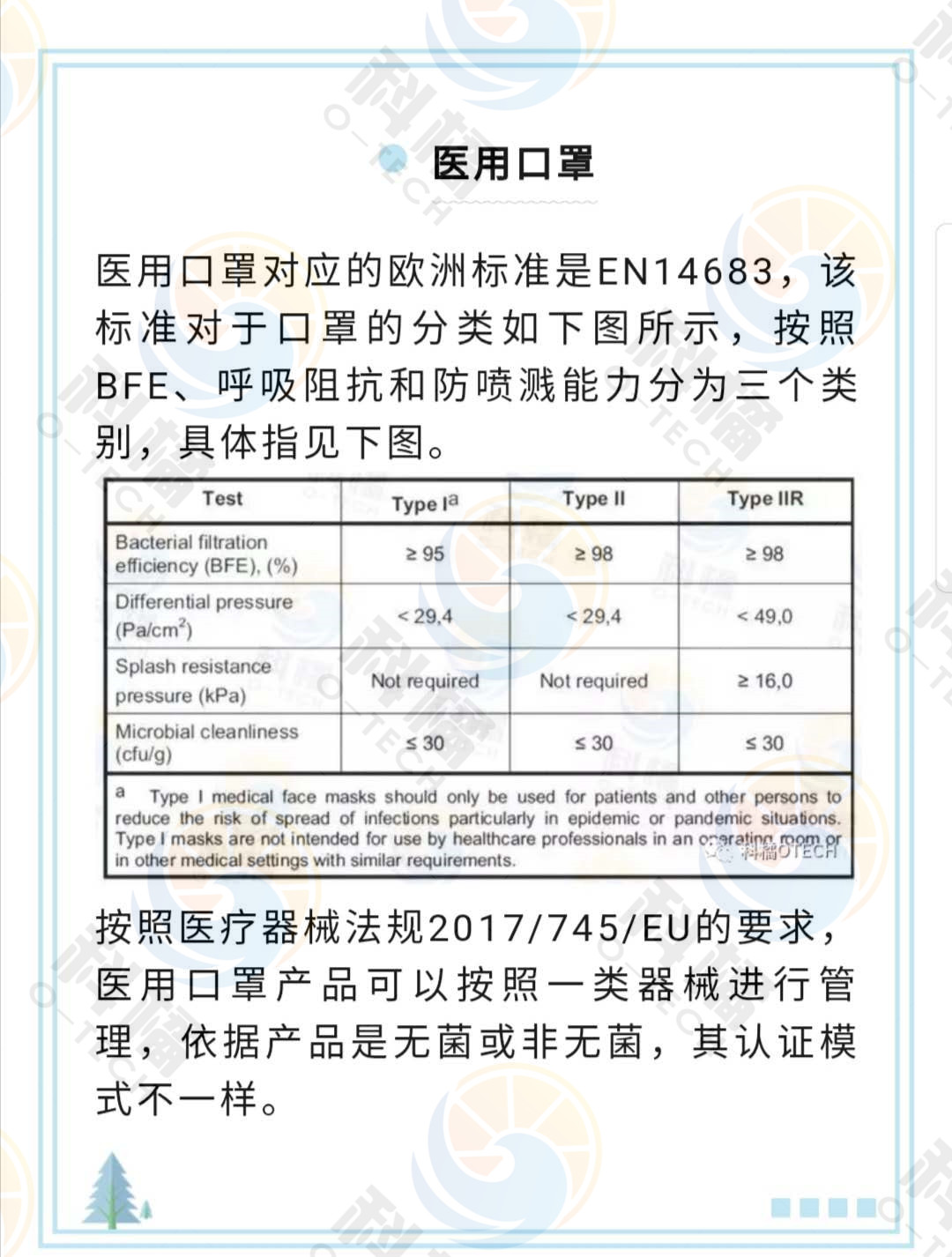
1)编制技术文件
2)提供测试报告(可以提供熔喷布性能测试报告和无纺布的生物学报告)
3)编制DOC
4)指定欧盟授权代表并完成欧洲注册
5)建立ISO13485体系(并不强制)
注意:非无菌并不是对生产环境完全不控制,EN14683对产品的初始污染菌要求不大于30cfu/g。(不要求NB机构发证,企业可自我宣称)
1)灭菌验证
2)建立ISO13485体系
3)编制技术文件
4)提供测试报告(口罩本身的生物学、性能、无菌等测试报告)
5)公告机构审核(目前只能按照MDR审核,预计近期没有NB可以审核)
6)获CE证书
7)指定欧盟授权代表并完成欧洲注册
注:必须有资质NB机构发证,时间:至少半年
防护口罩的欧洲标准:EN149。按照标准将口罩分为FFP1/FFP2和FFP3三个类别,具体的指标见下图。

防护口罩需要满足欧盟个人防护设备指令(PPE)的要求,防护口罩属于其中复杂设计的产品。
1)填写申请书,提供产品的型式试验报告;
2)送样测试;
3)工厂质量体系审查Module D;
4)Module B模式下的文件审核;
5)欧州需要授权的公告机构并颁发证书。

美国法规对医用口罩和工业防护口罩同样是区分管理:医用口罩由FDA管控,防护口罩由NIOSH管控。
美国医用口罩属于规则878.404,分类为二类,且需要申请510K批准,方案如下:
医用口罩申请FDA 510(K)批准,周期:4~6个月。
1)进行产品测试(性能测试、生物学测试)
2)准备510K文件,提交FDA评审
3)FDA发510K批准信
4)完成工厂注册和器械列名
5)产品出口
个人防护口罩的美国标准:NIOSH认证。
1)送样品到NIOSH认可的实验室进行预检,通常为美国实验室
2)编写技术文件提交NIOSH评审,一般包括:产品图纸、产品说明、质量体系文件、测试报告
3)工厂检查
4)核发证书





企业咨询
咨询热线
400-099-9825