您的
智能关务管家

400-099-9825




您的
智能关务管家

400-099-9825








2021-08-11
随着疫情的扩散以及公众健康意识增强,高品质医疗器械的需求不断增长,而在需求增长的同时,各国政府为确保医疗器械的安全性,也制定了相应的法律法规。而我国医疗器械行业要想出海,就必须对相关国家的法律法规有所了解。
本期小科整理了各个国家和地区医疗器械的准入要求,供大家参考。
医疗器械定义
常见医疗器械产品
对应海关税则号
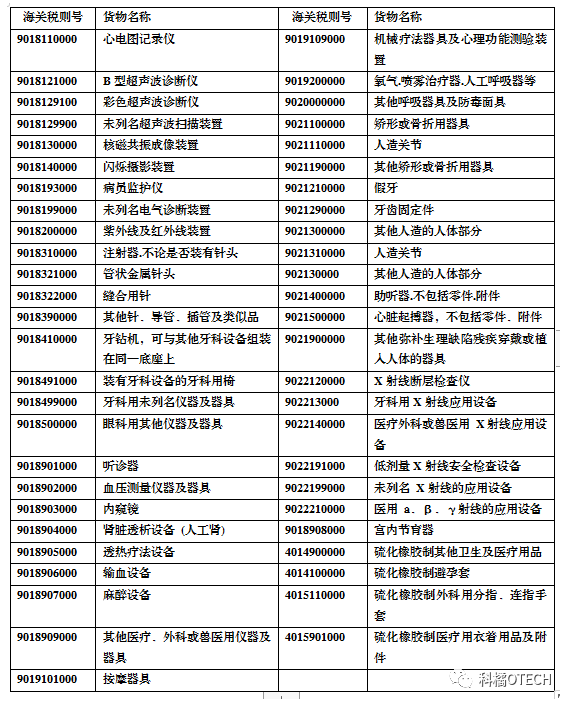
主要国家和地区分类及要求
美国FDA
分类
准入要求
欧盟CE





企业咨询
咨询热线
400-099-9825